L’Istituto Superiore di Sanità ha recentemente pubblicato la relazione parlamentare sulla legge 40/2004 in merito alla Procreazione Medicalmente Assistita (PMA) con i dati del 2018 e nel novembre 2020 è uscito il Certificato di assistenza al parto (CeDAP) contenente le statistiche sulle nascite a livello nazionale risalenti all’anno 2017.
È ormai risaputo quanto l’Italia e le sue regioni siano sempre più inibite in materia di nascite sia per ragioni socio-culturali – che non toccheremo in quanto materia non pertinente al nostro gruppo – che per infertilità patologica o idiopatica.
Come si evince dalle statistiche (Tabella I), la maggior parte delle madri ha un’età compresa tra i 30 e i 39 anni (59.54%), seguite dalle giovani under 30 (29.08%) e dalle over 40 (10.19%).
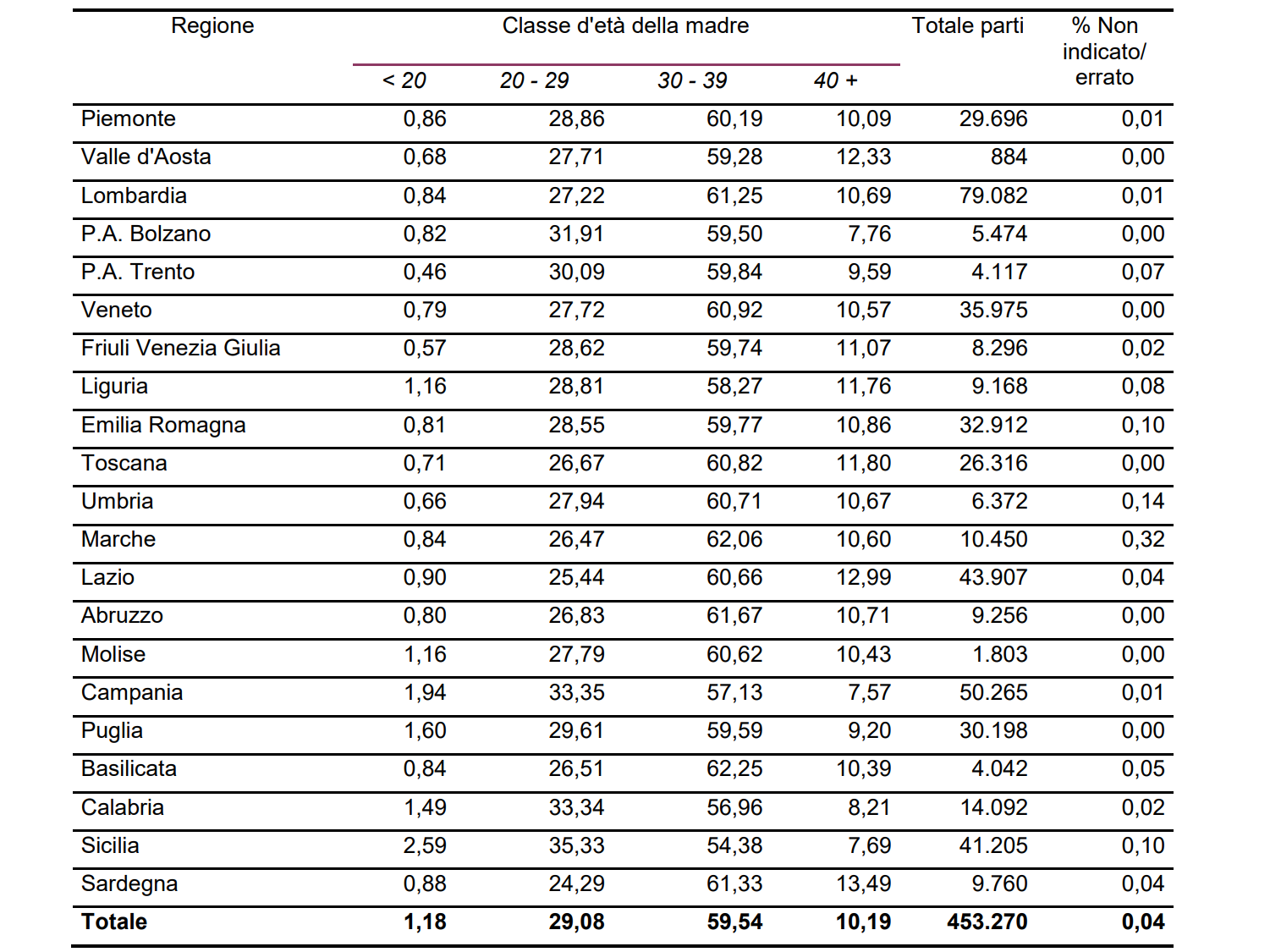
Questi dati sono significativi se si considera la varietà di cause che limitano le gravidanze e che hanno una stretta correlazione con l’età e la salute dei partner. Infatti, si è registrato un aumento delle nascite tramite tecniche di procreazione assistita (dati relativi al 2018), che sono risultate pari al 3.2% (rispetto ai nati del medesimo anno).
Quali fattori possono impedire la procreazione?
Il principale fattore per cui si rende necessario il ricorso al percorso di procreazione assistita risiede nell’impossibilità di una coppia di procreare in modo spontaneo. Come già anticipato, spesso si tratta di infertilità (per cui dopo ripetuti tentativi non si verifica la gravidanza) ma vi sono anche altri casi, più o meno dibattuti, come la presenza di handicap fisici (ad esempio tetra/paraplegia o disfunzioni dell’apparato urogenitale) oppure partner dello stesso genere, per cui questa strada risulta l’unica possibile. Vi sono poi condizioni per cui le coppie non riescono ad avere figli pur non presentando alcun sintomo, sterilità sine causa o idiopatica.
Le cause più comuni negli uomini possono essere legate a danni temporanei o permanenti dell’apparato riproduttore, come ad esempio la quantità, la morfologia e la motilità degli spermatozoi in seguito a traumi, interventi chirurgici, a terapie invasive oppure per ereditarietà genetica o tumori (Figura 1).

Nelle donne l’insorgenza di patologie come l’endometriosi, l’occlusione tubarica, sindromi ovariche ed un irregolare ciclo ormonale (Figura 2) possono compromettere ed ostacolare il percorso dell’ovocita maturo, qualora fosse stato rilasciato, e quindi il naturale processo di fecondazione e di impianto. Inoltre, con l’avanzare dell’età della donna uno dei principali rischi è quello di incorrere in una fisiologica diminuzione della riserva ovarica, ovvero della capacità di produrre ovociti maturi. Il fattore genetico, come ad esempio la mutazione dei geni BRCA che aumentano la predisposizione allo sviluppo del carcinoma alla mammella e del tumore ovarico, se diagnosticato per tempo, può comportare l’infertilità a causa dell’asportazione delle ovaie, delle ghiandole mammarie e delle tube di Falloppio a scopo preventivo.

Procreazione Medicalmente Assistita (PMA)
In Italia la terapia convenzionale che viene utilizzata per permettere a coppie sterili di procreare, prevede un percorso validato ed assodato, regolamentato dalla legge 40/2004. Il Ministero della Salute classifica le tecnologie disponibili in base all’invasività della procedura di intervento, suddividendole in tre livelli.
Livello I
Le tecniche di primo livello sono le meno invasive in quanto si preleva il liquido seminale del partner, lo si processa – talvolta lo si può crioconservare – e si procede con l’inseminazione intra/sopracervicale. In questa fase è anche possibile ricorrere alla stimolazione ormonale nella donna per aumentare la produzione di follicoli, incrementando le probabilità di concepimento.
Livello II
In questo livello vi sono diversi approcci che possono essere impiegati e che comunemente prevedono la manipolazione dei gameti in vitro; per tale motivo il grado di invasività aumenta e le procedure vengono effettuate con la sedazione controllata. Infatti, tra le fasi più complesse vi sono il prelievo degli ovociti dopo un’intensa cura stimolante, la fecondazione in vitro (FIVET) oppure la diretta iniezione dello spermatozoo nella cellula uovo (ICSI) per ottenere molteplici embrioni (è necessario ricavare un buon quantitativo di embrioni, regolamentato per legge, per poter favorire più di un trasferimento intrauterino e più di un tentativo); quindi si procede con il trasferimento dei gameti per via isteroscopica o transvaginale.
Livello III
Le tecniche di questo ultimo livello devono necessariamente essere svolte in anestesia totale, in quanto il prelievo dei gameti dai testicoli viene effettuato per via microchirurgica, mentre quello ovocitario avviene in laparoscopia. Infine, il trasferimento dei gameti può richiedere di nuovo la procedura laparoscopica al fine di essere efficace.
Nuove tecniche in fase di studio
Le tecniche PMA sono tendenzialmente costose, invasive e psicologicamente difficili da sopportare, poiché i trattamenti possono occupare un lasso di tempo relativamente ampio a seconda del livello e del numero di tentativi – 3/6 tentativi in media – con una percentuale di successo che varia dal 10.6% per le tecniche di I livello al 30.6% per le tecniche di livello II e III con scongelamento di embrioni (senza la donazione di gameti).
Uno studio accurato ed una diagnosi precoce di infertilità possono sicuramente agevolare l’avvicinamento di coppie infertili a queste procedure. Inoltre, tecniche meno note come il trapianto, ad esempio di utero e di tessuto ovarico, sono state eseguite su donne che hanno affrontato radio/chemioterapia, consentendo il ripristino dell’attività ormonale così come il bilancio endocrino e l’attività riproduttiva. Al contrario, il trapianto di testicoli per l’apparato riproduttivo maschile è stato effettuato una sola volta in una coppia di gemelli e, dato l’elevato tasso di rigetto e la quasi totale assenza di protocolli, ad oggi i testicoli e le altre componenti dell’urogenitale maschile non sono oggetto di questa pratica. Tuttavia, data la difficoltà nel reperire donatori compatibili, il rischio di rigetto da parte del ricevente e la necessità di essere supportati per tutta la vita da cure immunosoppressive, nuovi metodi alternativi di ingegneria dei tessuti sono attualmente in fase di studio.
L’ingegneria dei tessuti per il trattamento dell’infertilità
Scaffold: strutture di supporto per la maturazione in vitro dei gameti
La creazione di modelli tridimensionali in vitro che possano permettere di studiare e di riprodurre un tessuto funzionante anche attraverso il supporto di matrici e strutture esogene biocompatibili è una delle possibili strade della bioingegneria. In particolare risulta fondamentale garantire un ambiente con una rigidezza simile a quella dell’ambiente in vivo e una configurazione tale da favorire i processi fisiologici. Per tale ragione gli scaffold maggiormente utilizzati sono in collagene, alginato, chitosano e fibrina perché facilmente reperibili, manipolabili e, soprattutto, biologici.
Ad esempio, in uno studio è stato testato un tessuto sintetico, ora in sperimentazione clinica, in grado di inspessire l’endometrio basato su cellule staminali mesenchimali estratte dal Warton’s Jelly del cordone ombelicale e coltivate all’interno di uno scaffold di collagene. Altri ricercatori hanno utilizzato le nuove tecniche di bioprinting per stampare delle strutture dalla geometria controllata e verificare così quale architettura favorisse una maggiore adesione ed un più alto tasso di maturazione dei follicoli, che in un secondo momento hanno generato ovociti che hanno permesso la gravidanza nell’animale. Un altro esempio che rappresenta una possibile alternativa per la produzione di cellule uovo in vitro è rappresentato dall’utilizzo di microsfere di alginato che, circondando i follicoli, ne supportano tridimensionalmente la coltura e permettono la maturazione, facilitando il reimpianto in vivo (Figura 3).

Per quanto riguarda la generazione di cellule spermatiche in vitro vi sono pochi esempi funzionali. Anche in questo caso, sebbene non siano ancora stati ottenuti spermatozoi in vitro in modo efficiente, l’utilizzo di matrici di supporto che simulino al meglio il microambiente presente nei testicoli è cruciale per la coltura dei precursori spermatici (Figura 4). Un esempio di costrutto testicolare è stato ottenuto sfruttando la stampa 3D di uno scaffold di alginato per mantenere in coltura cellule testicolari corrispondenti alla fase pre-pubertà, consentendone il differenziamento per circa l’80%, senza però favorire la formazione delle strutture tubulari tipiche dei testicoli.

Organoidi: modelli mirati per la medicina personalizzata
L’utilizzo degli organoidi nella ricerca medica è diventato sempre più ampio per indagare la fenomenologia di certe patologie durante l’evoluzione di un tessuto umano, come anche l’infertilità. Questi modelli funzionali possono essere ricavati da cellule di un donatore o prelevate dal paziente stesso, permettendone la manipolazione in vitro e avvicinandosi sempre di più alla medicina personalizzata.
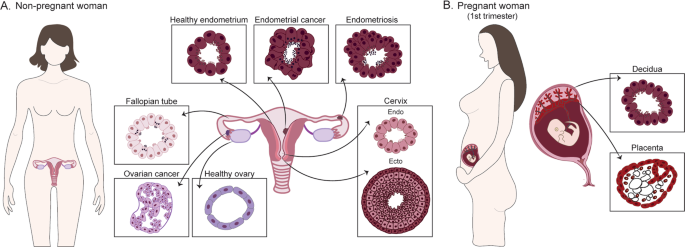
In un articolo recentemente pubblicato sulla rivista Cell & Death Differentiation da un gruppo di ricerca dell’Università di Cambridge, vengono presentati i più recenti avanzamenti tecnologici in questo campo, focalizzando l’attenzione esclusivamente all’infertilità dell’apparato riproduttivo femminile (Figura 5). Nello studio vengono messi a confronto gli organoidi ottenuti da cellule dell’endometrio sano rispetto a quelle da pazienti che soffrono di endometriosi o cancro, del tessuto ovarico, della cervice e delle tube di Falloppio per osservare la modalità di crescita di queste in un ambiente simil-nativo. Inoltre, è stato possibile ottenere da cellule della placenta e della decidua degli organoidi che replicano la costituzione di quei tessuti durante il primo trimestre di gravidanza, in maniera meno invasiva rispetto all’analisi che si effettuerebbe in modello animale. Lo sbocco di questa tecnologia conduce ad investire più risorse verso l’investigazione delle cause di infertilità idiopatica partendo da una semplice biopsia del tessuto della paziente.
Seppure in maniera molto più contenuta, sono stati effettuati studi nel campo degli organoidi testicolari. I ricercatori dell’Università Ben-Gurion di Negev in Israele, hanno analizzato la più recente letteratura scientifica a riguardo ed hanno raccolto interessanti informazioni su possibili strategie per preservare la fertilità maschile. Sono stati infatti ottenuti organoidi a partire da spermatogoni, cellule precursori degli spermatozoi, combinandoli in vitro con le cellule di Leydig e del Sertoli in presenza di una matrice extracellulare ricavata da tessuto testicolare (Figura 6). Questa struttura ha permesso di ricavare, dopo 3 settimane di coltura, cellule aploidi: un passo avanti verso la sintesi in vitro di cellule spermatiche. È stato possibile riprodurre in vitro anche organoidi testicolari in grado di secernere ormoni, ad esempio il testosterone, ma non ancora in grado di differenziare spermatociti.

Conclusioni
Le nuove tecnologie si stanno dimostrando sempre più efficaci nel sopperire al problema dell’infertilità sia nell’uomo che nella donna.
Le tecniche di PMA non sono curative e non risolvono la patologia in maniera totale, per cui si rende necessario approfondire le cause che portano all’infertilità anche quando questa non viene diagnosticata, in modo da poterne prevenire l’insorgenza. Specialmente nel caso di patologie ereditarie è possibile crioconservare follicoli e porzioni del tessuto testicolare, oppure tentare la strada del trapianto da donatore.
Anche la ricerca nel campo dell’ingegneria dei tessuti si sta occupando di infertilità. Esistono ad oggi numerosi modelli in vitro per lo studio della fenomenologia di malattie come l’endometriosi, il cancro alla cervice e il tumore all’ovaio, ottenuti accoppiando biomateriali che sfruttando la tecnologia degli organoidi in una configurazione 3D per ottenere risposte mirate senza incorrere nel cambio di specie, cosa che si avrebbe considerando i test preclinici. Infine, è notizia recente che i ricercatori dell’Università di Monash (Australia) hanno ottenuto in vitro un modello di blastocisti a partire da cellule epiteliali umane riprogrammate con la tecnologia di induzione a pluripotenza, mai sperimentato prima. Con questo nuovo modello di studio, sarà d’ora in avanti possibile osservare ed analizzare lo sviluppo embrionale senza incorrere in vincoli etici, al fine di poter incrementare l’efficienza delle tecniche di fecondazione in vitro, oltre che a studiare la genetica dell’infertilità.
Fonti e approfondimenti
- Ansa – Marzo mese dell’endometriosi, colpite 3 milioni di italiane
- Ansa – Nel 2018 più nati con la fecondazione assistita ma ci sono gap Regioni
- Relazione Ministero della Salute – Attività dei centri di procreazione medicalmente assistita anno 2018
- Ministero della Salute – Procreazione Medicalmente Assistita in Italia
- CeDAP – Certificato Ministeriale di Assistenza al Parto anno 2017
- IJMS – Human ovarian cortex biobanking: a fascinating resource for fertility preservation in cancer
- Journal of Translational Medicine – Ovarian function and reproductive outcome after ovarian tissue transplantation: a systematic review
- Review Urology – A Review of Transplantation Practice of the Urologic Organs: Is It Only Achievable for the Kidney?
- NatRev – Engineering reproductive tissues
- Life Science – Scaffold-based tissue engineering approaches in treating infertility
- NatCom – A bioprosthetic ovary created using 3D printed microporous scaffolds restores ovarian function in sterilized mice
- Biomaterials – The crucial role of mechanical heterogeneity in regulating follicle development and ovulation with engineered ovarian microtissue
- Stem Cell– Characterization, recellularization, and transplantation of rat decellularized testis scaffold with bone marrow-derived mesenchymal stem cells
- Cell Death and Differentiation – Organoid systems to study the human female reproductive tract and pregnancy
- IJMS Male – Approaches and technologies in male fertility preservation
- Biology of Reproduction – Three-dimensional testicular organoid: a novel tool for the study of human spermatogenesis and gonadotoxicity in vitro
- iBlastoids – Modelling human blastocysts by reprogramming fibroblasts into iBlastoids








